患者衍生的癌症模型是癌症研究和药物开发不可或缺的工具。
1. 患者来源肿瘤细胞培养(PDC)
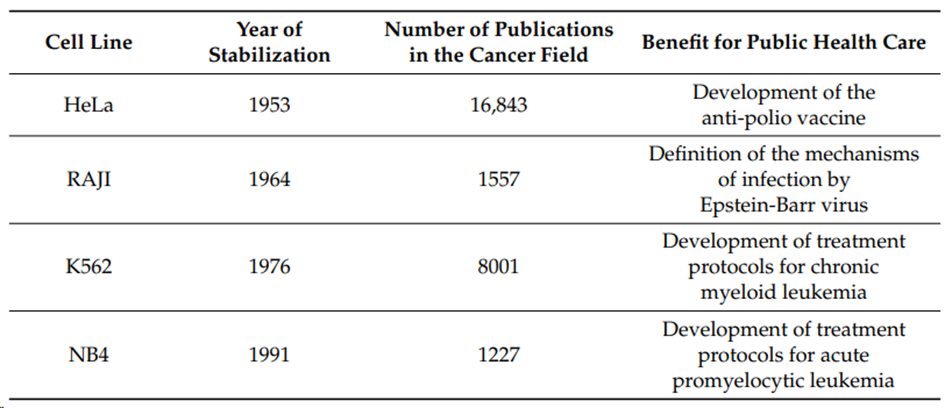
PDC是直接从肿瘤组织或患者体液(腹水、支气管-肺泡灌洗液、外周血)中分离出的患者癌细胞建立的原代细胞培养物。通常已知的癌细胞系最初是原代患者来源的肿瘤细胞培养物,由于长时间的连续传代或永生化,成为广泛使用的癌细胞系。例如“80岁”高龄的HeLa细胞(源于Henrietta Lacks)。
Cancers 2019
数百个细胞系保留了基因组多样性和起源肿瘤的特征,因此可以用作体外癌症模型。
全球知名细胞库:美国模式培养物集存库—ATCC、 欧洲认证细胞培养物收藏中心—ECACC、莱布尼茨研究所德国微生物与细胞培养物保藏中心—DSMZ、韩国细胞系库—KCLB、日本研究生物资源库保藏库—JCRB、理研细胞库—RCD等。
商业肿瘤细胞系的缺点是细胞异质性低,缺乏基质和免疫成分,而且细胞系经历了无数次细胞传代、分裂、获得性突变,可能无法反映肿瘤的真是特征。
为了更好模拟肿瘤的真实特征,依旧需要建立原代PDC,但是难度较大。且PDC是2D培养不能完全再现肿瘤结构。
2-3.患者来源肿瘤球(PDS)和类器官(PDO)
肿瘤是三维(3D)结构,经历异质的氧气和营养物质可用性、代谢物去除和药物暴露。由于实体瘤缺氧和血管形成不足,形成缺氧区域,诱导肿瘤细胞代谢改变。因此,为了在体外模拟肿瘤结构尽可能接近体内条件,已经开发了球状体和类器官形式的 3D 培养模型 。
肿瘤球是通过直接细胞浓缩和在小培养基体积中培养而获得的细胞聚集体。球体不能自组装,也不需要支架。换句话说,球状体是通过细胞间粘附临时组装成三维细胞结构的细胞层。Sutherland等人于1971年首次描述了球状体。作者在悬浮培养中培养了V79中国仓鼠肺细胞,从而形成了多细胞球体,其中含有弱循环细胞,在形态上具有一些动物和人类癌的特征。然后,从脑、乳腺、肺、结肠、前列腺、胰腺和卵巢肿瘤中获得肿瘤球体。肿瘤球是肿瘤细胞和癌干细胞/祖细胞的混合物,可以在不附着于表面的情况下存活和增殖。
类器官最初在组织学和遗传结构上更为复杂,与起源于原始肿瘤相似。类器官由具有干性特性的干细胞、祖细胞或肿瘤细胞形成,并概括了原始组织或器官的表型、遗传和转录组特征。类器官的主要优点是概括了不同细胞谱系的原代组织结构(通常具有中央管腔)和功能。
起源于肿瘤细胞的类器官称为“类瘤”,在组织学上与原始肿瘤相似,易于繁殖,适用于高通量系统。2009年,Hans Klevers使用从小肠隐窝底部分离的LGR5 1干细胞成功获得了第一个类器官。癌症类器官已从多种癌症发展而来,包括胃癌、结直肠癌、肝癌、胰腺导管腺癌、前列腺癌和乳腺癌等。
PDS作为一种体外肿瘤模型具有许多优点:它们反映了三维肿瘤结构,建立成本低,适合大规模筛选。PDS的缺点是结构组织不良,缺乏不同的细胞谱系。类器官模型是一种更先进的模型,可以保持原始癌症的异质性,并可以概括组织结构。因此,目前大多数体外研究正在转向使用类器官作为更接近原始肿瘤组织的模型。
类器官和球状体代表了更可靠的体外癌症模型。研究发现,与2D细胞培养相比,肿瘤球体对抗癌药物和辐射具有相当的抵抗力。大量研究表明,类器官对药物的体外反应与小鼠和人类体内原发肿瘤的相应反应呈正相关。
4. 复杂PDO模型
肿瘤微环境包括细胞外基质(ECM)和基质细胞,如癌症相关成纤维细胞(CAF)、免疫细胞(粒细胞、淋巴细胞、巨噬细胞),它们在肿瘤发展和耐药性中起着关键作用。
为了模拟在肿瘤中但在体外条件下发生的直接细胞间通讯,进行了类器官与肿瘤相关细胞的共培养。这种方法通常涉及分别培养类器官、癌症相关成纤维细胞和免疫细胞,然后创建复杂的肿瘤类器官培养物(重建方法)。应该注意的是,可以修改类器官建立方案,以便保留肿瘤组织的小片段,并将瘤内基质细胞纳入形成复杂的类器官中(整体方法)。
肿瘤基质的关键成分之一是CAF(癌症相关成纤维细胞),可来源于常驻成纤维细胞、上皮细胞、内皮细胞(通过上皮-间充质转化-EMT)、迁移的骨髓来源和脂肪来源的间充质干细胞(MSC)、星状细胞。CAF创建并重塑细胞外基质(ECM)的结构,影响血管生成、药物获取和对治疗的反应,调节免疫细胞的活性。CAF衍生因子可诱导肿瘤支持微环境并促进癌细胞转移。因此,建立了肿瘤类器官与CAFs的3D共培养模型。
这种共培养方法的优点是更接近肿瘤组织。缺点是细胞间和细胞-基质接触的繁殖有限,细胞类型和劳动强度的比例不正确。
与通过共培养几种细胞类型在肿瘤类器官中构建TME相比,建议将患者肿瘤样本直接接种到基质胶中,而无需肿瘤组织解离步骤。该程序可以保留肿瘤细胞-基质相互作用和基质细胞的异质性。在这种方法中,将肿瘤组织切割成碎片,将其嵌入胶原凝胶中并放置在transwell的上部隔室中。transwell 的下部隔室充满培养基,而胶原包埋的肿瘤组织的顶部暴露在空气中,因此,该方法称为气液界面 (ALI) 培养。在ALI方法中,类器官生长时不添加外部因素,因为这些因子被认为是由类器官内的基质细胞产生的。
5. 患者来源的组织切片培养
组织切片培养(TSC)是众所周知的技术,用于研究正常组织的生理过程,例如肺组织、神经组织。TSC的方法包括将组织或器官置于1.5%琼脂糖中,然后使用振动切片机切割琼脂糖块并在培养基中培养获得的切片。
患者来源的组织切片培养方法包括使用无菌活检打孔器取出肿瘤组织,使用振动切片机切割约200-500μm厚的肿瘤切片,将获得的PDTSC置于含有生长培养基的培养板中,并在振荡下孵育PDTSCs。为了增加细胞的保存和存活,PDTSC可以在膜插入物上培养,膜插入物为肿瘤切片提供机械支撑,增加的氧气供应弥补了PDTSC功能性血液供应的不足。
PDTSCs反映了肿瘤的代谢活性、肿瘤细胞密度、增殖率、异质性和对化疗的临床反应。在这种情况下,PDTSC是评估抗癌化合物在复杂肿瘤微环境中有效性的合适替代模型。
PDTSC可以研究抗癌药物对肿瘤相关细胞活性和活力的影响。用纳武利尤单抗治疗肾细胞癌PDTSC可显著降低PD-1的表达,并影响肿瘤浸润CD8+ T细胞的密度和增殖。
患者来源的组织切片培养 (PDTSC) 作为离体 3D 癌症模型的优势在于保留组织病理学、肿瘤微环境,包括细胞间接触和多种细胞。与通过ALI方法获得的PDO相比,PDTSC的另一个优点是,由于操作较少,因此耗时更少。PDTSC模型可在一天内建立;研究PDTSC对化疗的反应大约需要2日(取决于治疗期)。缺点是仅适用于实体恶性肿瘤,不能完全反映肿瘤的复杂性,并且寿命有限。
6. 患者来源的异种移植物
PDX模型是通过将新切除的患者肿瘤的一部分直接移植到动物模型中而创建的。最初,PDX是在小鼠中建立的,小鼠PDX模型(mPDX)仍然是肿瘤学研究的金标准。由于 mPDX 模型的局限性,替代 PDX 和开发了斑马鱼患者来源的异种移植物(zPDX)、雏鸡绒毛膜尿囊膜患者来源的异种移植物(CAM-PDXs)、人源化 mPDX、PDX 来源的类器官(PDXO)和细胞培养物(PDXC)等 PDX 衍生模型。
mPDX的优点是概括了复杂的肿瘤微环境、肿瘤细胞异质性和肿瘤的原始结构、免疫调节以及肿瘤细胞在体内暴露于广谱细胞因子、趋化因子、生长因子和激素。PDX小鼠模型广泛用于癌症研究,为我们对癌症生物学的理解做出了巨大贡献。然而,哺乳动物中的PDX模型有一些缺点。首先,创建一个完整的PDX队列用于体内药物筛选需要4到8个月的时间。而大多数患者,例如患有难治性癌症的患者,寿命不到 1 年 (NCT02646228),并且不太可能获得筛查结果。其次,根据肿瘤的类型,植入肿瘤的成功植入率和生长率在25-75%之间。其次,维护PDX小鼠模型既费力又费时又昂贵。
zPDX
另一种PDX模型是斑马鱼患者来源的异种移植(zPDX)模型,该模型由于低成本、高通量和快速建立而广泛应用于癌症研究。虽然斑马鱼不是哺乳动物,体温不同,但它们的肌肉骨骼、心血管系统、眼睛、大脑、肝脏、心脏、胃肠道和胰腺与哺乳动物相似。
斑马鱼的透明和半透明特征使其成为研究肿瘤脉管系统发展、肿瘤生长和转移的理想模型。为了可视化血管并研究肿瘤诱导的血管生成,已经产生了具有血管内皮细胞特异性表达GFP的转基因斑马鱼。
研究发现,在啮齿动物模型(mPDX)中,对斑马鱼(zPDX模型)测定的化疗药物的相对敏感性保持不变。zPDX 作为动物模型的独特优势是周转快、成本低和通量高,因为斑马鱼每周可以孵化 150-200 个卵。zPDX的快速建立和获得结果(约72-144小时)使其适用于短期临床治疗。此外,zPDX模型的特点是空间要求小,筛选药物剂量低。与mPDX模型相比,zPDX的样本量要求较小(数百个细胞足以进行移植),并且需要相对最少的维护和护理。
zPDX的缺点包括异种移植注射后死亡率高、水中给药结果难以转化、疏水性药物和静脉注射给药复杂,以及鱼和人体温不同。斑马鱼喜欢28°C的环境温度;然而,它们能够在32至36°C的温度下生存,更接近人类细胞培养条件。肿瘤细胞移植后,斑马鱼胚胎通常在33°C下孵育,作为允许人类癌细胞和鱼类生长的折衷方案。然而,在稍低的温度下饲养的人体细胞的代谢发生显著改变,导致增殖减少、存活率改变和对化疗的反应。
CAM-PDX
鸡蛋绒毛膜尿囊膜(CAM)是另一种替代体内 PDX 模型。由于鸡胚在第18天之前缺乏功能性适应性免疫系统,并且被认为是非生命动物,因此CAM模型更易于建立。在第 7 天或第 8 天的受精卵中,当 CAM 完全发育出“窗口”时,它们通过钻壳和破坏内膜来制备。然后,将肿瘤碎片(3 × 3 × 3 mm3)转移到血管“Y”型分叉附近的CAM并任其生长。移植人类肿瘤样本后3-4日即可形成肿瘤。使用复发性呼吸道状瘤病组织碎片进行CAM移植的成功率达到73%,观察到喉鳞状细胞癌移植组织碎片的存活率为100%。
CAM历来被用于研究癌细胞诱导的血管生成。其高血管分布可刺激肿瘤生长,并可作为筛选抗血管生成药物的模型。移植后,肿瘤移植物在2-5日内被雏鸡血管血管化,从而支持肿瘤体积和质量的快速生长。
CAM上肿瘤生长的分析通常依赖于显微镜的目视检查和结节大小或重量的量化。
CAM-PDX已被证明可以维持原始肿瘤的异质性、病理生理学以及主要形态学和细胞学特征。CAM-PDX的特点是胶质母细胞瘤、肉瘤、鼻咽癌和肾细胞癌的成功率高达80-100%。
CAM-PDX模型的优点是成本低、易于可视化和可操作。该模型允许同时筛选大量药物(高通量)。癌细胞可以很容易地、非侵入性地植入,并且可以在免疫缺陷的环境中植入。建立 CAM-PDX 并获得结果大约需要 2 周时间。然而,从另一个角度来看,由于观察期短,这种优势(获得结果的时间短)不会获得可见的转移。此外,与哺乳动物相比,雏鸡的药物代谢和免疫系统不同,可能导致不同的药物反应。
人源化mPDX
下一代PDX 是人源化模型,其中小鼠静脉注射人源性 CD34+ 造血干细胞(HSC)以创建有效的人类免疫系统 。具有人类免疫系统的PDX有助于研究人类癌症与人类免疫细胞之间的相互作用。通过检测小鼠外周血中分化的人CD45+细胞来评估人免疫细胞的成功植入。为了支持移植的人类免疫细胞的增殖和分化,已经创造了产生IL-3、GM-CSF、SCF、TPO和/或M-CSF等生长因子的转基因和敲除株。人源化 mPDX 更准确地反映了在患者中观察到的疾病表型,并在药物筛选中使用时提供更具临床相关性的结果。人源化PDX模型的局限性之一是人类免疫细胞与移植肿瘤的同种异体性,因为通常很难从癌症患者身上获取造血干细胞。同种异体免疫细胞扭曲了PDX中癌症和免疫细胞之间的相互作用模式。
PDXO和PDXC
小鼠PDX模型成本高,需要较长的实验时间,因此研究生成PDX衍生的类器官(PDXO)和原代PDX衍生的细胞培养物(PDXC),以获得大规模筛选抗癌药物的平台。
获得PDXC的过程包括从具有PDX的动物中分离肿瘤移植物,将其切成小块,然后分解成单个细胞(类似于从肿瘤活检中获得原代细胞培养物的通常程序)并接种在培养皿上。PDXO的建立过程包括轻度肿瘤解离,然后进行差异离心,旨在富集类器官和耗尽的单细胞。PDXO在预测体内药物反应方面的适用性,PDXO的药物筛选结果与乳腺癌mPDX的药物反应之间的一致性,PDXO和PDXC显示出模型特异性生长动力学和药物反应:mPDX和相应的PDXO在药物反应方面观察到最大的重叠。
与亲本 mPDX 模型相比,PDXC 和 PDXO 的主要优点是建立成本更低和通量高。重要的是,PDXC和PDXO具有匹配的PDX模型,可以在研究的第一步进行大规模筛选,选择潜在的候选药物,并在第二步返回mPDX模型。该实验方案可以减少实验中使用的动物数量,使用体内mPDX模型验证获得的数据,并提高体外和体内数据的可比性。然而,这些模型的特征分别是细胞培养物和类器官的上述所有缺点,即缺乏原始肿瘤结构,缺乏复杂的肿瘤微环境,没有暴露于广谱细胞因子、趋化因子、生长因子和激素。
动物PDX是一种生理相关的肿瘤模型,能够准确再现肿瘤细胞多样性、肿瘤进展,包括转移的发展。因此,PDX模型在临床试验中被广泛用于治疗转移性肾细胞癌(CAM-PDX模型,NCT04602702)、复发性转移性头颈部鳞状细胞癌(mPDX模型,NCT02752932)、转移性前列腺癌(mPDX模型,NCT03786848)患者。另一项临床试验(mPDX模型,NCT03134027)研究了使用人血CD34+造血干细胞/祖细胞(HSPCs)生成人源化mPDX模型,以在PDX模型中重建相应的人体免疫系统,并避免宿主免疫系统排斥肿瘤植入。在成功完成临床研究后,可以将PDX药物筛选方法引入临床实践。














